流感病毒是一种重要的人兽共患性病原体。据世界卫生组织统计数据,全球每年约有10亿人感染流感病毒,导致约300-500万重症病例,25-50万死亡病例。同时,近年来H5亚型高致病性禽流感的全球流行给养禽业带来毁灭性的打击,造成数以亿计的家禽和野生鸟类死亡。值得注意的是,家鸭虽然对流感病毒易感,但多数为无症状带毒,不易出现临床症状。研究表明,家鸭对流感病毒具有较强的适应性免疫,但是其机制尚不清楚,而主要组织相容性复合体 (Major histocompatibility complex, MHC) 是机体适应性免疫的重要组成部分。因此构建家鸭完整MHC基因图谱、深度挖掘与适应性免疫相关的基因,是解析家鸭对流感病毒适应性免疫机制的重要途径。
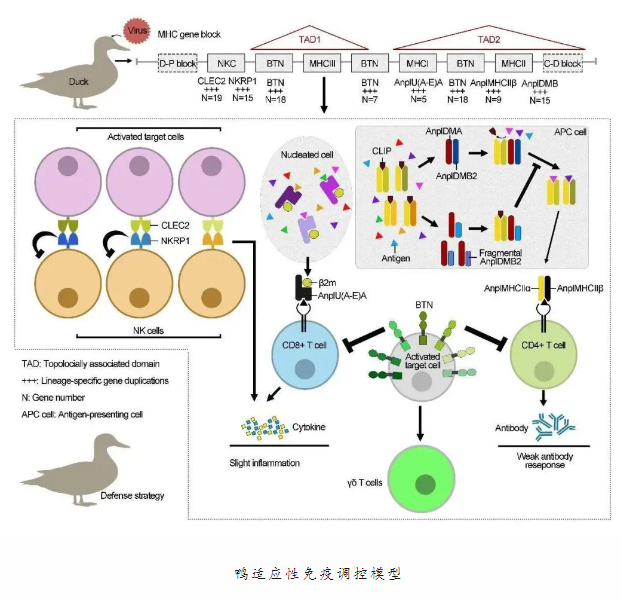
中国农业大学生物学院黄银花教授长期致力于家禽基因组及抗流感病毒机制研究,此次与动物医学院孙洪磊教授合作,在国际上首次绘制出家鸭MHC基因图谱,并对MHC区域基因家族进行深入分析,证实了鸭适应性免疫相关基因有助于鸭抗流感病毒的假说,有望为科学防控流感病毒提供新策略和新思路。该研究论文2024年1月21日在线发表在国际著名生物学杂志《BMC生物学》(BMC biology)。为克服MHC区域基因密度大、多态性高, 常规的 BAC 测序和全基因组组装测序均难于获得该区域基因组序列图谱等卡点,研究团队运用三代单分子和二代测序数据, 结合光学图谱和高通量染色体构象捕获技术的辅助组装方法,成功构建包含 40 条染色体的北京鸭参考基因组序列 (SKLA1.0),并注释了 17896 个编码基因和66217 条转录本。与国际上现有4个北京鸭基因组、模式生物鸡和斑胸草雀高质量基因组相比,SKLA1.0 具有更高的连续性(比北京鸭基因组提高近6倍), 且基因组序列和注释基因集更为完整。更重要的是,该研究基于高质量的北京鸭参考基因组序列SKLA1.0, 在国际上首次构建了鸭MHC 区域完整的基因组序列图谱和基因图谱,发现鸭的MHC保留原始两栖动物该区域的核心基因框架,但是显著扩增MHCI和MHCII类分子、自然杀伤细胞受体以及嗜乳脂蛋白基因。研究人员进一步分析鸭MHC基因家族功能,揭示鸭抗禽流感病毒的适应性免疫机制,包括:多样化的MHC分子通过广泛高效识别病原和激活机体适应性免疫,提升鸭对不同病原的免疫监视能力;多样化的抑制性NK细胞受体和乳脂球蛋白可有效调节适应性免疫反应强度,避免炎症风暴的发生;大量MHCII伴侣分子DMB假基因降低了鸭抗原递呈效率,限制了机体对禽流感病毒或疫苗产生抗体的能力,这既可解释鸭具有更强的抗禽流感能力的重要原因,也为水禽禽流感疫苗改进提供了新的思路。在此之前,黄银花教授团队绘制了国际上首张家鸭遗传连锁图谱和物理图谱(Genetics),构建了全球首个禽流感病毒天然宿主—鸭的全基因组序列精细图谱、结构变异图谱、基因图谱和禽流感病毒感染鸭肺转录组图谱(Nature Genetics封面文章),系统阐明了重要抗禽流感病毒免疫基因OAS功能分化和抗病分子调控机制(Science China Life Sciences, Frontiers in Immunology, BMC Evolutionary and Biology)。这是该团队在家禽基因组和抗病免疫领域取得的又一项重要研究成果,为深度解析水禽抗禽流感适应性免疫机制和研发水禽专用高效禽流感疫苗指明了方向。中国农业大学生物学院黄银花教授和动物兽医学院孙洪磊教授为该研究论文的共同通讯作者,生物学院已毕业博士研究生胡加祥、宋林霏和宁梦菲以及在读博士生牛心语为共同第一作者。中国农业大学动物医学院刘金华教授和蒲娟教授、江苏省农业科学院李慧芳研究员和扬州大学龚道清教授参与了本项研究工作。西北工业大学王文教授、中国农业大学赵要风教授和华中农业大学周红波教授给本项目研究提供了宝贵的建议。该研究得到现代农业产业技术体系项目(CARS-42)和国家自然科学基金面上项目(32172716)的经费资助。