 |
国家兽药产业技术创新联盟 National veterinary drug industry technology innovation alliance |
用户登录
联系我们
|
兽药产品批准文号是农业农村部根据兽药国家标准、生产工艺和生产条件批准特定兽药生产企业生产特定兽药产品时核发的兽药批准证明文件。在兽药产品批准文号审批依据[1]中,法规和规章类9项、技术标准类16项。其中,《兽药管理条例》为文号管理的最高上位法,《兽药产品批准参考文号管理办法》为文号审批工作规章,其余相关管理规章及技术标准均为文号审批管理支持性规定文件。本文对近几年文号管理相关制度和技术标准的新要求和审查中常见问题进行了解析,为兽药生产企业申请兽药产品批准文号提供参考。
1.1兽药产品比对试验目录制管理
为解决部分原研药品供应短缺、价格昂贵及垄断市场等问题,降低畜牧养殖业防疫与治疗成本,农业农村部以养殖需求为导向,按照科学合理、分类实施、逐步推进的思路,鼓励、指导与原研药品等效的仿制兽药生产,对进口兽药和部分新兽药实施比对,制定了兽药比对试验目录。兽药比对试验目录产品的管理方式,除可降低原研兽药的价格,打破原研兽药市场垄断外,还可进一步促进兽药生产企业研究新的生产方法,提高制药工程技术水平,优化产业结构,加速兽药生产企业变革。兽药比对试验目录由农业农村部兽药评审中心拟定,农业农村部公布,目前已公布5批共计422个产品。值得注意的是,目录中备注“无合法原料”和“本品为仿制品”的产品,目前无法进行文号申请。同时,为确保兽药产品安全、有效和质量可控,2016年12月,农业部办公厅发布《兽药比对试验产品药学研究等资料要求》。
1.2《中华人民共和国兽药典》(2020年版)颁布实施
2021年7月1日,《中国兽药典》(2020年版)正式实施,加强了安全性、有效性研究,提高了产品质量标准,持续完善了附录体系。新收载了部分已过监测期兽药注册标准,这些标准中一些产品已列入比对试验目录,申请文号时仍执行比对试验目录制管理。修订品种中包括部分质量标准通用名的规范性修订,如卡巴匹林钙可溶性粉改为卡巴匹林钙粉。中药部分,对将原中药提取物类部分质量标准修订为成方制剂类,此类产品的批准文号前缀将由“兽药原字”变更为“兽药字”,而批准文号的后四位品种编码不发生变化。
1.3产品复核检验指导原则的修订
2022年3月,农业农村部按照“突出重点,把控关键”的原则修订了《兽药产品批准文号复核检验工作指导原则》。主要变化集中在一是扩大了首次申请文号产品检验的范围,由检验1批产品全项目检验变为检验3批样品,检验项目覆盖质量标准中所有检验项目。二是对迁址重建等取得过文号的产品申请文号的,不再全项目检验,而是按照不同剂型产品的必检项目和关键项目进行检验。三是按照兽用生物制品类型制定必检项目和关键项目。四是加强对文号有效期内存在监督抽检不合格情形产品的检验。这类产品在换发文号时,需进行3批产品的检验,检验项目覆盖质量标准中所有检验项目。
1.4《兽药GMP(2020修订)》的实施
2020年6月1日起,《兽药生产质量管理规范(2020年修订)》开始正式施行。此版兽药GMP修订以我国兽药行业特点和实际管理需求为基础,吸收了欧盟和我国药品GMP有关技术标准,更新了洁净区动态级别规定,将兽药生产洁净室(区)的空气洁净度的分级标准与WHO和欧盟GMP保持一致,提高了兽药生产厂房设施的建设标准和要求。兽药产品批准文号申请人提交生产工艺资料时,对生产洁净室(区)的设置及描述应符合《兽药生产质量管理规范(2020年修订)》要求。
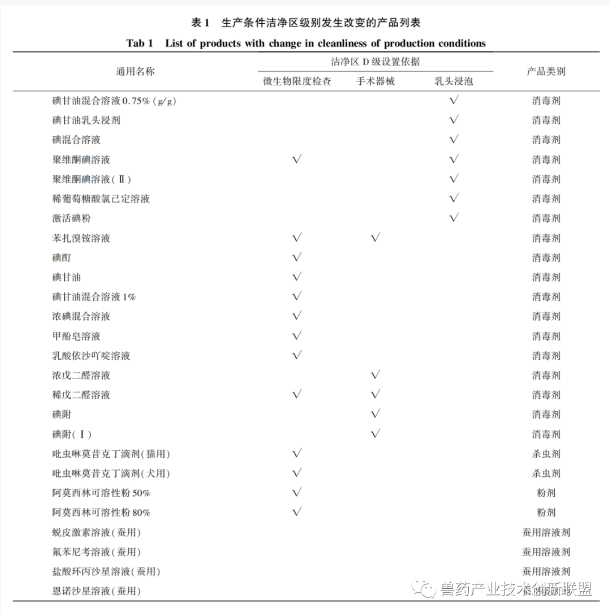
《兽药生产质量管理规范(2020年修订)》非无菌兽药附录第四条要求,质量标准有微生物限度检查等要求或对生产环境有温湿度要求的产品,应有与其要求相适应的生产环境和设施。据此,2021年,农业农村部出台的《兽药生产许可管理和兽药GMP检查验收有关细化要求》中,明确质量标准中具有微生物限度检查项目、用于乳头浸泡和手术器械消毒的产品,其生产条件应按照D级洁净区的要求设置,共涉及22个品种的生产条件发生了改变,其生产线名称应体现生产区洁净度级别。
1.5生产线的设置
2021年,农业农村部办公厅发布了修订后的《兽药GMP生产线名称表》,对生产线名称进行了规范。如产品生产线未在名录上,应先向部畜牧兽医局进行新生产线名称的申请,获得新生产线名称后,才能申请文号。2022年,农业农村部畜牧兽医局新增了6种兽药GMP生产线,一部分为新兽药注册产品的新生产线,分别是喷雾剂(D级)、搽剂(D级)、蚕用溶液剂(D级)、非最终灭菌大容量注射剂(激素类),另一部分为新生产工艺生产线粉针剂(吹灌封)、最终灭菌小容量注射剂(激素类,吹灌封)。

2.1关于监测期
《兽药管理条例》第二十一条规定国务院兽医行政管理部门,根据保证动物产品质量安全和人体健康的需要,可以对新兽药设立不超过5年的监测期;在监测期内,不得批准其他企业生产或者进口该新兽药。
2.1.1监测期的计算
新兽药监测期期限分为5年、4年、3年和不设监测期共4种情况,监测期的设定需要综合考虑新兽药类别、是否在国内外销售、生产工艺信息等多种因素。不同质量标准的同一通用名称且靶动物相同的新兽药,包括该品种不同规格,以该新兽药第一个产品批准文号生效日期为监测期起始日期。例如:烯丙孕素内服溶液分别公布在农业农村部公告16、101、145、186号及农业部公告2653号中,烯丙孕素内服溶液的监测期为4年,第一个产品批准文号为2018年6月4日批准,因此该品种的监测期为2018.6.4-2022.6.3。
对于新增靶动物的产品,其监测期以获得新靶动物批准注册的日期为监测期起始日期;已有此产品文号的申请人无需申请换发产品批准文号,按照农业农村部批准的标签说明书样稿自行修改并印制、使用产品标签说明书即可。
2.1.2监测期内产品文号的审批
根据农业部公告第1899号规定,监测期内的新兽药,每个品种,包括同一品种的不同规格,只能由新兽药注册企业生产,但最多不超过3家(必要时,按注册排序确定)。新兽药注册单位中兽药生产企业超过3家的,需提供由所有新兽药注册单位盖章确认的监测期内生产企业名单,如所有新兽药注册单位确认不能就生产权形成一致意见,则按新兽药注册单位先后排序确定生产企业名单。在申请文号时,需提供相关证明资料。
对已经列入目录中的进口兽药注册产品,如果其同品种的新兽药产品在监测期内,若其同品种新兽药尚处在监测期内的,可以开展比对试验,需待同品种过监测期后方可进行兽药产品批准文号申请。
2.2关于产品品种编号
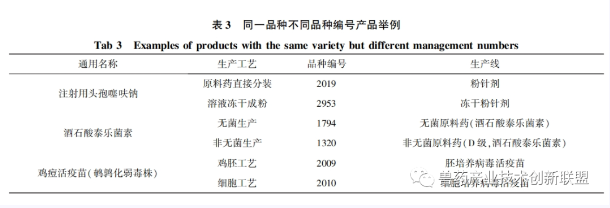
兽药产品批准文号的编制格式为兽药类别简称+9位数字编码。其中前5位为兽药生产许可证号,后4位为兽药品种编号。部分产品虽然通用名一致,但因生产工艺不同或质量标准不同,需要的生产条件差别很大。这类产品将根据生产工艺或质量标准分别进行品种编号编制。例如注射用头孢噻呋钠(规格按C19H17N5O7S3计0.1g)质量标准为2020CVP-1,存在原料药直接分装和溶液冻干成粉两种完全不同的生产工艺,生产线也分别为粉针剂和冻干粉针剂。分装工艺粉针剂品种编号为2019,冻干工艺粉针剂品种编号则为2953。又如,原料药酒石酸泰乐菌素,存在无菌和非无菌两种质量标准。无菌原料药品种编号为1794,非无菌原料药品种编号为1320。
2.3关于比对试验目录产品审查
比对试验目录产品的研究实际上就是仿制药的研究过程,通过自产品和参比品药学研究和临床试验结果的比对,确认自产品在效果上与参比品一致。为保证试验结果的正确性,在研究中使用的参比品必须是具有合法来源的,即已获得上市批准的产品。在文号审查中,无论是市场购买获得还是赠送获得,申请人均需提供参比品批准信息和购买凭证等合法来源证明。同时,根据比对试验目录不同产品的要求,申请人需提供药学研究资料和临床试验资料,由农业农村部新兽药评审员专家库专家进行评审。目前比对试验资料质量良莠不齐,问题集中体现在试验设计、技术标准和资料的完整性、规范性方面。
首先试验设计上,比对试验目录上的产品为进口兽药注册和新兽药注册产品,在发布注册审批公告时,产品的生产工艺和质量标准因知识产权保护的原因并不公开,申请人的研究应聚焦在自研品与参比品在安全性和有效性的比较研究上,而不是单纯质量标准的比较研究,无法获得参比品的质量标准会影响自研品的研制是不成立的。其次,研制比对试验目录产品的本质就是仿制,其药学研究和临床试验的技术要求应与新兽药注册中的三类原料药仿制药和五类制剂仿制药一致,并不因审批管理方式的不同而不同,其评审尺度与兽药注册评审尺度是一致的。对比对试验目录产品研究资料的评审是降低了技术标准的“小评审”,这种想法是不正确的。三是研究资料的完整性和规范性上失误较多,如研究图谱提供不完整、文字描述与图表信息不一致等,没有提供有效目录、英文缩略语有误、计算错误或数据单位有误等所谓的“小”问题,同样会影响文号审批的整体进度。
2.4关于特殊品种生产线要求
产品需要在《兽药生产许可证》载明的生产范围内,符合要求的生产线上生产。一些特殊的产品仅从通用名称上看,很容易混淆生产线。例如,硫酸锌粉(水产用),容易认为生产线为粉剂,其实它的用途是杀虫剂,符合要求的生产线应为“外用杀虫剂(固体)”。硫代硫酸钠粉(水产用)、过氧化钙粉(水产用)等产品的生产线应为“消毒剂(固体)”。灭蚕蝇溶液的生产线应为“蚕用溶液剂”而非外用杀虫剂(液体)。此外,氟尼辛葡甲胺注射液也是非常特殊的产品,该注射剂生产线如为“最终灭菌大容量静脉注射剂”,方可在标签和说明书【用法与用量】中印制静脉注射相关内容。
兽药产品批准文号审批为产品上市的最后一道关口。兽药产业政策调整、兽药GMP技术标准发展、产品质量标准提高和监管需求变化均会影响文号审批。随着行业发展,兽药研发、生产、文号管理从环环紧扣到日益融合,兽药文号审批向着“注册制”转变的趋势已经逐渐形成。申请文号需要提交的资料将由生产工艺规程文件性资料向产品工艺、质量研究资料转变。这一点可以从2023年1月管理部门公开征求《兽药产品批准文号管理办法(部分修订征求意见稿)》内容可见一斑。兽药管理模式的变化也将从根本上降低产品同质化、提升产业集中度、解决批准文号“闲置”的问题。未来,兽药研发、生产的技术标准将更加严谨,研发成果转化更加高效,兽药监管更加精准,安全有效、质量可控的兽药作为养殖投入品,从源头上保障畜禽产品质量和人民群众“舌尖上的安全”。
免责声明
本栏目旨在信息共享交流,此文版权归原作者及期刊所有,若有来源错误或者侵犯您的合法权益,请及时联系我们。
本文内容节选自《中国兽药杂志》2023年10月第57卷第10期
作者:中国兽医药品监察所 安洪泽,冯克清,陈莎莎,吴 涛
国家兽药产业技术创新联盟 National veterinary drug industry technology innovation alliance |
扫一扫  |
| 联系电话:010-62103991转611 联系地址:北京市海淀区中关村南大街8号 备案:京ICP备20024024号 |