 |
国家兽药产业技术创新联盟 National veterinary drug industry technology innovation alliance |
用户登录
联系我们
|
1 假溶原(Psedolysogeny)和携带者状态(carrier state)定义 1.1 回顾混乱的定义历程
综上所述,研究人员早已认识到噬菌体-宿主相互作用的复杂性,超出了经典的裂解-溶原途径。然而,长期以来关于噬菌体假溶原/携带者状态的概念和术语上的混淆,犹如盲人摸象(图1),阻碍了这类超越经典的裂解-溶原途径的相关研究的进展。
1.2 单细胞水平或群体水平进行重新定义
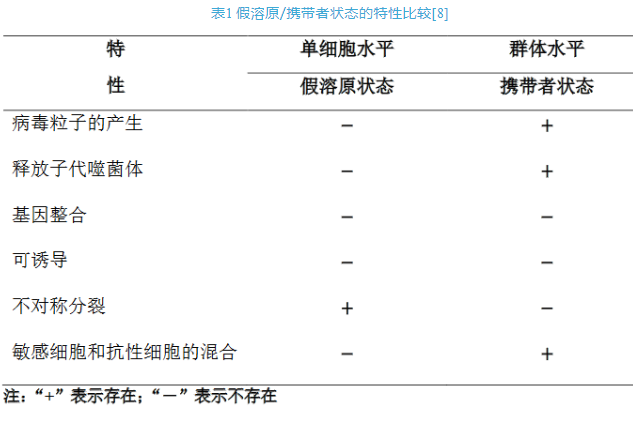

图2 假溶原/携带者状态的感染策略模式图[8]。(A)假溶原状态显示一个停滞的噬菌体发育阶段,其中未整合的噬菌体基因组不对称地传递给子代细胞。子代细胞可能通过噬菌体基因组的遗传或免疫因子(如噬菌体P22)对重复感染产生抗性(用红色“×”表示)。随后的细胞分裂稀释免疫因子,细菌亚群最终对噬菌体感染变得敏感(用绿色“√”表示)。(B)携带者状态描述噬菌体和细菌的混合物处于群体水平上的动态平衡,这是由于抗性细菌中存在敏感变异(易受噬菌体感染,因此容易发生噬菌体诱导裂解)。抗噬菌体的亚群可能是由宿主细胞的遗传和生理变化引起的。如图,噬菌体受体(野生型菌毛,橙色)的缺乏(无菌毛)或表型变化(菌毛突变体,蓝色)或细胞内噬菌体颗粒的存在诱导了噬菌体抗性的产生
2 噬菌体假溶原/携带者状态的研究进展

近期,王鹏/乐率团队[13]发现鼠疫耶尔森氏菌(Yersinia pestis)噬菌体HQ103存在携带者状态。而且,研究发现鼠疫菌编码的组蛋白样核结构蛋白H-NS在21℃高表达,以沉默该噬菌体的Cox启动子Pe,从而抑制其进入裂解周期;而在37℃时,由于鼠疫菌H-NS的减少,且该噬菌体抑制蛋白CI的截短以及启动子Pc的突变,从而使噬菌体HQ103从携带者状态转换成裂解状态,裂解鼠疫菌(图5)。同时,经土壤中细菌-噬菌体协同进化实验证实,在环境温度(21℃)下,噬菌体HQ103的携带者状态可以促进噬菌体-宿主菌共存(图5)。

图5 鼠疫菌编码的温度依赖性的组蛋白样核结构蛋白H-NS调控噬菌体HQ103裂解-携带者状态转换的机制示意图[13]
3 噬菌体假溶原/携带者状态的研究挑战 近些年,越来越多的噬菌体呈现假溶原/携带者状态,体现了噬菌体假溶原/携带者状态的普遍性,其具有重要的生态学意义,挑战了传统的裂解-溶原途径。但是,基于它们可能是条件依赖的,短暂的或仅发生在受感染宿主细菌群体的一部分,处于假溶原/携带者状态的噬菌体经常被忽视,局限了学者对它们的认识和重视,希望本文的简述能引起学者的关注和促进相关研究。 [1] Stent GS. Bacterial Viruses. (Book Reviews: Molecular Biology of Bacterial Viruses). Science, 1964. 143. [2] Baess I. Report on a pseudolysogenic mycobacterium and a review of the literature concerning pseudolysogeny. Acta Pathol Microbiol Scand B Microbiol Immunol, 1971. 79(3): p. 428-34. [3] Barksdale L and Arden SB. Persisting bacteriophage infections, lysogeny, and phage conversions. Annu Rev Microbiol, 1974. 28(0): p. 265-99. [4] Ackermann HW and Dubow MS. Viruses of prokaryotes. CRC Press, 1987. [5] Ripp S and Miller RV. The role of pseudolysogeny in bacteriophage-host interactions in a natural freshwater environment. Microbiology (Reading), 1997. 143(6): p. 2065-2070. [6] RippS and Miller RV. Dynamics of the pseudolysogenic response in slowly growing cells of Pseudomonas aeruginosa. Microbiology (Reading), 1998. 144 ( Pt 8): p. 2225-2232. [7] Abedon ST. Disambiguating bacteriophage pseudolysogeny: an historical analysis of lysogeny, pseudolysogeny,and the phage carrier state. In Contemporary trends in bacteriophage research(ed. HT Aadms), 2009. pp 285-307. New York, NY: Nova Science Publisher. [8] Mäntynen S, Laanto E, Oksanen HM, Poranen MM and Diaz-Munoz SL. Black box of phage-bacterium interactions: exploring alternative phage infection strategies. Open Biol, 2021. 11(9): p. 210188. [9] Brathwaite KJ, Siringan P, Connerton PL and Connerton IF, Host adaption to the bacteriophage carrier state of Campylobacter jejuni. Res Microbiol, 2015. 166(6): p. 504-15. [10] Liang L and Connerton IF. FlhF(T368A) modulates motility in the bacteriophage carrier state of Campylobacter jejuni. Mol Microbiol, 2018. 110(4): p. 616-633. [11] Cenens, W., et al., Viral Transmission Dynamics at Single-Cell Resolution Reveal Transiently Immune Subpopulations Caused by a Carrier State Association. PLoS Genet, 2015. 11(12): p. e1005770. [12] Staes I, Backer LE, Simones K, Lavigne R, Bernaerts K, and Aertsen A. Superinfection exclusion factors drive a history-dependent switch from vertical to horizontal phage transmission. Cell Rep, 2022. 39(6): p. 110804. [13] Yang LH, Wang J, Lu SG, Zhong YH, Xong K, Liu XX, Liu B, Wang XX, Wang P and Le S. Temperature-dependent carrier state mediated by H-NS promotes the long-term coexistence of Y. pestis and a phage in soil. PLoS Pathog, 2023. 19(6): p. e1011470. 专家简介
国家兽药产业技术创新联盟 National veterinary drug industry technology innovation alliance |
扫一扫  |
| 联系电话:010-62103991转611 联系地址:北京市海淀区中关村南大街8号 备案:京ICP备20024024号 |