国家兽药产业技术创新联盟致力于建立产业技术发展信息交流平台,收集了解产业技术创新过程中的需求,为联盟成员单位提供技术、产品、人力资源和信息、咨询、培训等综合服务;受企业委托,对科技成果的技术水平和产业化前景进行评估;定期举办兽药行业技术创新论坛,加强成员单位间的信息交流,提出切实建议,凝聚产业共识,积极为国家政策献言献策,引导行业健康发展。为此,联盟微信公众号设立《新技术&研究进展》栏目,收集、发布兽药产业相关技术创新及研究进展。
为探讨优化我国兽用生物制品支原体检验方法的可能性,从支原体检验方法、培养基种类及培养条件、培养基质量控制和检验操作方法四个方面,对中国、美国和欧盟兽用生物制品支原体检验方法进行系统比较,分析不同方法之间的差异及优劣。结果发现,与美国《联邦法规》第九卷及《欧洲药典》相比《中国兽药典》支原体检验方法有培养基种类及配方成分全面等方面的优势,但在培养基质量控制方法、检验过程控制、检验标准制定等方面还存在不足。正视这些差距与不足,提出改进和验证的方向,可为我国兽用生物制品支原体检验的优化提供参考。基金项目:兽药行业公益性重点专项(GY202007)作者简介:马欣,助理研究员,硕士,从事细菌类生物制品的检测及相关科研工作。通讯作者:罗玉峰。E-mail:luoyufengmy@163.com支原体是兽用生物制品中较常见的污染物,其主要来源于环境、污染的种毒、细胞或鸡胚等。支原体污染会对兽用生物制品生产的一致性及产品的安全性产生重大影响。高效、敏感、准确的检验方法可以提高支原体污染的检出效率,降低污染扩散风险,保障畜牧业健康发展。不同国家对兽用生物制品支原体检验依据各异,中国兽用生物制品支原体检验依据现行《中国兽药典》2020版第三部附录3308;美国兽用生物制品支原体检验依据现行《美国联邦法规》第九卷(以下简称9CFR)113.28;欧盟国家兽用生物制品支原体检验依据现行《欧洲药典》10.0版(EP10.0)2.6.7章节。本文对美国、欧盟和我国兽用生物制品支原体检验方法进行对比,从支原体检验方法、培养基种类、培养基质量控制和操作方法等四个方面分析不同方法之间的差异及优势,以期为国内现有支原体检验方法的优化提供新思路。三部法典所规定的支原体检验方法存在一定的差异,《中国兽药典》和9CFR中支原体检验方法为培养法,《欧洲药典》 中支原体的检验方法有三种,分别为培养法、指示细胞培养法和核酸扩增检测法。《欧洲药典》 规定对种子细胞库、工作细胞库、病毒种子批或者对照细胞进行支原体检验时,需要同时使用培养法和指示细胞培养法;在对病毒原液、半成品和成品进行支原体检验时,需用培养法;如需要筛选培养基可以选用指示细胞培养法;核酸扩增检测法则需通过验证试验后方可对前两种方法进行替代。培养法是支原体检验的经典方法。虽然在上述三部法典中培养法在细节上不尽相同,但大致步骤均为用液体培养基培养待检样品,每隔一段时间进行固体培养基和液体培养基移植,最后根据固体平板上菌落生长情况判定结果。该方法根据支原体的生长特性通过长时间培养和多次移植,可检出能在培养基中生长的各类支原体,具有较高的普适性和灵敏度。但是培养法需要28~29日的检验周期,对于一些需要快速通行的中间产物或半成品检验具有一定的局限性。由于培养法是《中国兽药典》和9CFR中支原体检验的唯一方法,因此本文将重点比较三部法典中支原体检验培养法的差别。指示细胞培养法是将检品接种于指示细胞中培养,然后用特异荧光染料染色,在显微镜下观察是否有支原体DNA着色。该方法虽然在《中国兽药典》和9CFR中未提及,但是在医药领域已是成熟的检验方法,其作为第二种支原体检验法被收录在《中国药典》、《欧洲药典》和《美国药典》 中。指示细胞培养法完整检验时间在14日左右,检验周期方面比培养法有优势,但由于该方法需要将检品与指示细胞共同培养,更适合检验细胞或培养基中支原体污染情况,若检品为可导致指示细胞病变的病毒样本,则需要用特异性抗血清先进行病毒中和,因此不适用于缺少有效中和抗体的高滴度病毒样本。支原体核酸扩增检测法(NAT)是用支原体特异性引物对检品中提取的核酸进行扩增,通过检测特定核酸序列来判定检品是否存在支原体污染。在《欧洲药典》中NAT法做为第三种支原体检测法可供选择,药典中未提供具体方法,根据验证指南对使用方法进行验证试验,若结果符合要求可作为培养法或指示细胞培养法的替代方法。9CFR中未提及NAT法,但是美国农业部兽医生物制品中心发布的检验规程中有一项为聚合酶链式反应检测支原体污染,该规程中提供了具体的检测方法,并表明此方法可与9CFR中的培养法结合或独立使用。NAT法具有检验周期短、操作简单、灵敏度高的特点,但是由于该方法检测出的是特定核酸序列,并非活的支原体,检验结果可能出现假阳性。《中国兽药典》、9CFR及《欧洲药典》中用于支原体检验的培养基各不相同。《中国兽药典》和9CFR中用于支原体检验的培养基各有三种和一种,由于《欧洲药典》同时应用于医药和兽药两个领域,故支原体检验用培养基种类较多,其中涉及兽药检验的有三种。三部法典中培养基种类及用途详见表1。
《中国兽药典》和《欧洲药典》针对禽源支原体和非禽源支原体检验均有相应的培养基,与 9CFR只有一种通用培养基相比,这两部法典的培养基种类更丰富。另外,考虑到对血清进行支原体检验时检品本身是一种培养基中添加的营养成分,《中国兽药典》设置了不添加血清的支原体培养基,更加全面地满足不同检品的需求。由于支原体基因组分子量小,生物合成能力有限,需从外界摄取大量能源物质,导致支原体对于生长条件要求较为苛刻,需要在营养物质丰富的培养基中才能生长。三部法典中培养基虽然在种类和数量方面有差异,但各培养基中营养成分类别大致相同。不同之处仅区别在是否添加指示剂、缓冲剂、辅酶、脱氧核糖核酸等物质。具体添加成分见表2,固体培养基成分与配套液体培养基除增加琼脂外基本一致。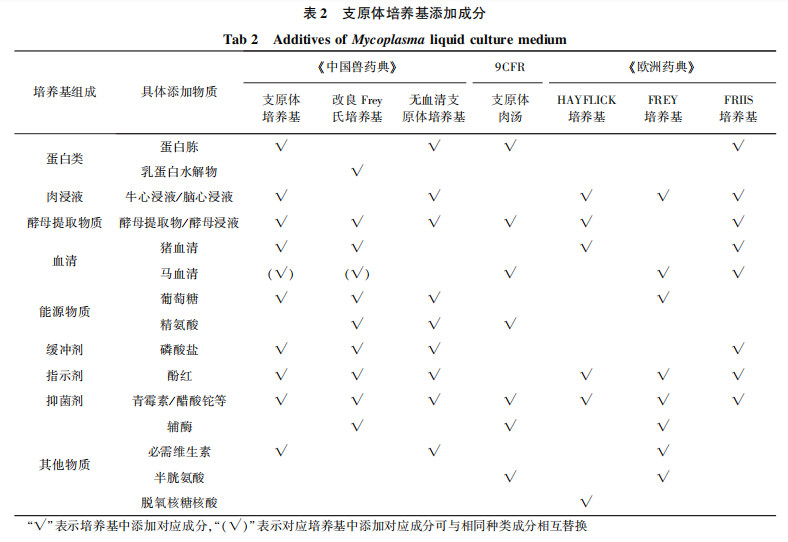
在培养基配方方面,三部法典的培养基中均含有对应适宜支原体生长所需的营养物质,如培养滑液囊支原体需在培养基中添加辅酶成分,在《中国兽药典》中用于禽源支原体检验的改良Frey氏培养基和《欧洲药典》 用于滑液囊支原体检验的FREY培养基中均有该成分,虽然9CFR只有一种支原体肉汤培养基,但也添加了辅酶成分,可以保证满足各类支原体的生长需求。9CFR的支原体肉汤培养基、《 欧洲药典》 的HAYFLICK培养基和FREY培养基中未添加有缓冲作用的无机盐,发酵型支原体在生长过程中会分解培养基中的糖类物质而产酸,然而支原体对于pH变化敏感,pH低于7.0的环境会抑制生长或导致死亡,因此支原体培养基应具有良好的缓冲能力,添加有缓冲作用的无机盐是有必要的。需要注意的是支原体对渗透压比较敏感,缓冲物质浓度应保持在一定限度。支原体肉汤培养基中未添加指示剂,可通过混浊度来辨别支原体是否生长,但是添加指示剂(通常为酚红)使得培养基的pH变化更容易被发现,有更强的提示作用。综上,《中国兽药典》中三种支原体培养基组成成分较为全面,可满足相应支原体的生长需求。通常情况下生物制品中污染支原体的含量比较少,因此培养基的质量优劣是能否检验出支原体污染的关键,培养基质量控制是为支原体检验保驾护航的重要步骤。《中国兽药典》和《欧洲药典》 中均规定了支原体检验用培养基质量控制方法,9CFR中没有相应规定,但是美国兽医生物制品补充检验方法(SAM)第910条支原体污染检测补充检验方法中,规定用促生长能力对培养基进行质量控制。三部法典的质量控制方法存在差异,具体内容比较见表 3。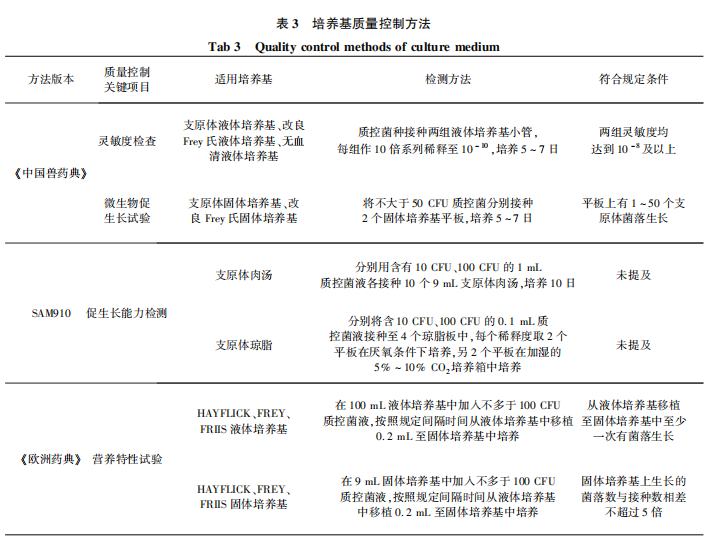
三部法典关于培养基质量控制用菌种也有所不同。《中国兽药典》 和9CFR中各有2种菌株用于支原体检验培养基质控,菌株种类及对应质控培养基类型见表4。《欧洲药典》中涉及兽用生物制品支原体培养基的质控菌株有5种,未明确规定不同培养基对质控菌种的选择,但规定质控菌种继代次数不能超过15代。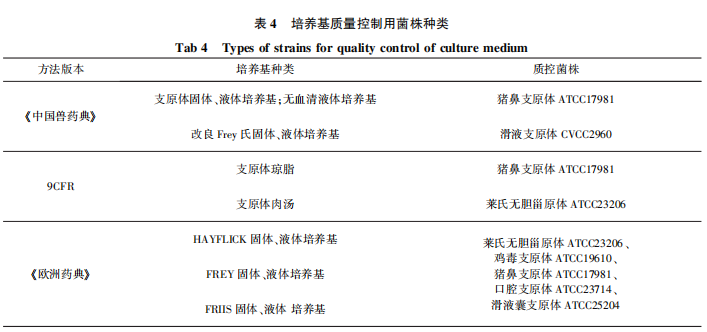
在培养基质量控制方面,《中国兽药典》和《欧洲药典》在液体培养基质量控制上检验方法虽不相同,但对于液体培养基灵敏度要求相似。需要注意的是,《中国兽药典》中所采用的观察液体培养颜色变化是间接指标,易受诸多因素干扰,用该方法进行培养基质控其结果的准确与否有待深入探讨。在固体培养基的质量控制中,《中国兽药典》微生物促生长试验要求将不大于50CFU质控菌株接种平板,菌落数为1~50CFU判定合格,《欧洲药典》营养代谢特性试验规定接种不多于100CFU质控菌株,要求菌落数与接种数量相差不超过5倍,菌落生长数量会因为培养基营养水平不同根据接种菌量在一定范围内浮动,因此对于菌落生长数量的上限及下限要求对培养基质量控制至关重要,《中国兽药典》中对于菌落生长数量的要求为一个固定的范围,未体现与接种菌量的关系。另外,《欧洲药典》对质控菌种的传代次数做出了规定(不超过15代),《中国兽药典》在2010年版时要求质控菌株传代不超过5代,在2015年版和现行2020年版中均无相应要求。支原体随着传代次数的增多,其生长特性会发生相应的变化,因此对于质控菌株的代次限制可对培养基质量控制的可靠性提供保障,质控菌株的最高代次还需根据进一步试验数据结果进行设定。三部法典规定的支原体检验操作方法存在差异,在取样量、培养温度、移植及培养观察时间、移植取样量、阳性对照接种量和对照成立条件上均有差别。支原体检验培养法具体差异比较见表5。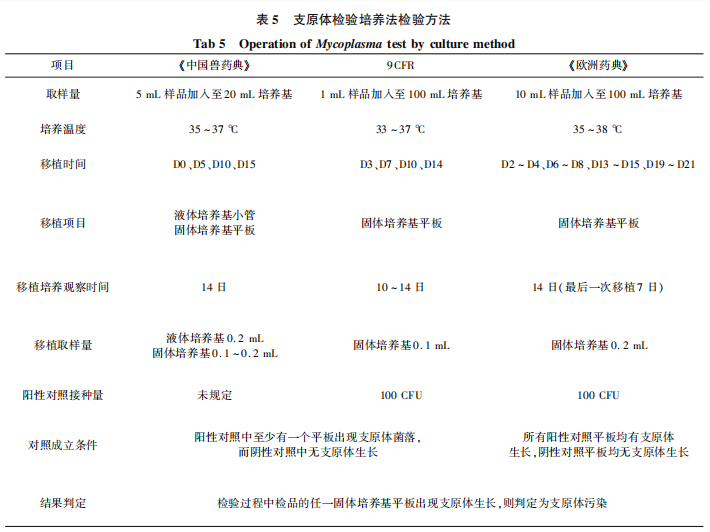
在支原体检验操作方法方面,《中国兽药典》中明确规定取5瓶样品进行检验,另两部法典未对取样方法进行说明。在取样量上,《中国兽药典》为5mL样品接种至20mL 培养基中,为1:4接种,在三部法典中接种浓度最高(9CFR 为1:100,《欧洲药典》为1:10),接种的检品在一定范围内占比越大,检出支原体污染的概率就越高,由此可见《中国兽药典》支原体检验在接种量方面要求最为严格。值得一提的是,《欧洲药典》在进行检验之前还会对给定产品进行抑制物质检测,通过对比培养基中添加检品和不添加检品的支原体菌株生长情况,检测其是否含有抑制物质。若结果含有抑制物质,则需进行中和或者经过加大培养基体积进行稀释后再进行抑制物质检查。该步骤能够避免一些检品中因含有抑制支原体生长物质导致支原体检验结果出现假阴性的问题,从而提高检验结果的准确性。《中国兽药典》在每次固体培养基平皿移植的同时也做液体培养基小管的移植,此步骤是其他法典中没有的。虽然在最后结果判定中是以固体平板为准,但是在实际检验过程中,液体小管的颜色变化对该次移植平皿中是否有支原体生长起了很好的提示作用,这一步骤是有必要的。《欧洲药典》 和SAM910均明确规定阳性对照接种菌量为不大于100CFU,而《中国兽药典》 没有相应要求,规定阳性对照接种量可以更好地反应本次移植培养基的质量情况,及时发现培养基质量问题,避免漏检情况出现。在试验成立条件方面,由于9CFR中阳性对照设定需接种至液体培养基与检品同时培养,每次移植取阳性对照培养物接种平板,有可能出现在第二次、第三次或第四次移植时由于培养基中营养成分耗尽或pH值变化较大,使得阳性对照培养瓶中已无活支原体的情况,因此,9CFR规定阳性对照中至少有一个平板出现支原体菌落即为试验成立。《中国兽药典》与《欧洲药典》每次移植时设定的阳性对照均为活的阳性对照菌株且《欧洲药典》要求每次接种菌量为100CFU,不存在类似9CFR在移植时无活的支原体的情况。但是《中国兽药典》在结果判定时仍规定为阳性对照中至少有一个平板出现支原体菌落即为试验成立,标准较低,相比之下《欧洲药典》中要求的所有阳性对照平板均有支原体生长为试验成立,能更好地确保每次移植试验结果的可靠性。支原体污染是兽用生物制品外源因子污染中最常见的问题,可靠的检验方法可以从源头减少支原体污染带来的安全隐患。在《 中国兽药典》、9CFR和《欧洲药典》 所涵盖的三种支原体检验方法中,培养法无论是在适用性还是结果的准确性方面均比其他两种方法有优势,目前仍是兽用生物制品支原体检验的金标准。NAT法具有高效、敏感的特点,弥补了培养法检验周期长的缺陷,是美国和欧盟均认可的支原体检测方法,在国内也有很多关于支原体检验PCR方法研究的报道。然而《中国药典》及《中国兽药典》均未收录该方法,表明国内对应用NAT方法持谨慎态度。究其原因除了因为该方法检出结果有假阳性的风险外,另一方面,若以此方法出具正式检验结果则对目的基因及引物序列有较高要求,既要有较强的特异性,确保不会对同源性强的细菌造成误检;又要具备较好的普适性,尽可能适用生物制品中常见的各类支原体,以免发生漏检。同时满足这两点要求对于目的基因以及对应引物的筛选可能有一定的难度。由于NAT法本身存在的这些特性,《欧洲药典》和《美国药典》并未将其作为官方方法与其他两种方法同样直接使用,而是要求需进行验证后方可使用,《欧洲药典》NAT法验证指南中对使用方法的特异性、最低检测限及耐用性提出了具体的要求。因此,若使用NAT法检测支原体污染或作为培养法、指示细胞培养法的替代方法,需对使用方法进行充分验证,可将该指南验证方法作为参考或进行优化,尽可能提高检验方法的特异性和适用性,避免误检和漏检的情况发生。在培养法方面,《中国兽药典》与9CFR和《欧洲药典》相比培养基种类及配方成分更全面,尽可能满足不同检品的需求;检验时检品接种量最大,对检品的要求更为严格,这些是我们的优势。但是通过比较也发现《中国兽药典》在培养基质量控制、检验操作及检验标准方面存在一些不足,在此提出一些改进和验证的思路,作为未来优化方向的参考。①在进行培养基质量控制时,明确质控菌种最高使用代次;②液体培养基的灵敏度检查法最终判定标准修改为以固体平皿上有菌落生长准;③固体培养基微生物促生长试验菌落生长数量根据接种数量进行定值;④在每次检验操作时,明确阳性对照接种数量;⑤ 适当提高检验时阳性对照成立标准。通过对《中国兽药典》、9CFR和《欧洲药典》进行系统比较,发现我国兽用生物制品支原体检验方法与欧美国家存在较大差异,既有优势也有不足。今后可从丰富支原体检验方法、优化培养基质量控制方法、规范检验过程控制,完善检验标准等方面进行改进和验证,以提高支原体检验的时效性和检测结果的准确性。







